抗体药物开发全流程
来源:原创文章作者:本站编辑时间:2022-10-25
2012年阿达木单抗荣登“药王”宝座,2014年起PD1/PD-L1掀起的免疫治疗热潮,以及ADC药物、双/多功能抗体等新型药物形式不断创新,大分子药物开发进入了一个黄金时代,国内产业紧跟全球步伐,各类生物技术公司如雨后春笋,对生物医药人才的需求也达到了前所未有的程度。
屏幕前的可能是刚毕业的学生、也可能是其他专业转做大分子药物、也可能已经在这行业摸爬滚打好几年,但可能未接受过系统的大分子药物开发培训,或对若干技术问题很困惑。希望通过这个系列文章,帮助各位了解这个产业的相关开发流程和一些细枝末节的问题。
本篇将介绍常规的抗体药物开发全流程。部分技术细节和流程会根据自身的产品特点调整开发策略。如有建议或意见,请各位读者后台留言交流。
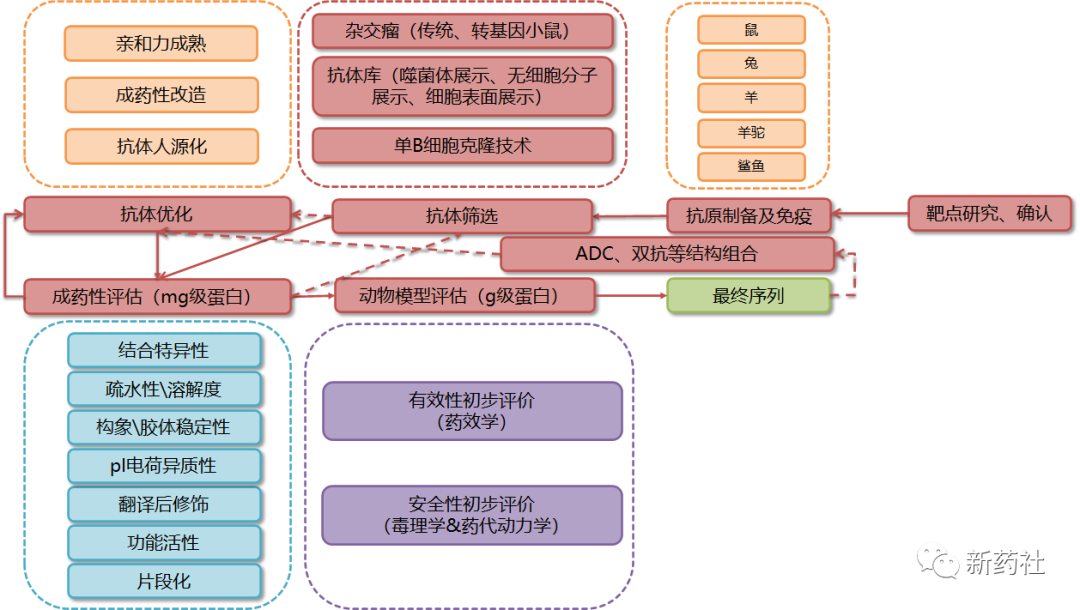
类似于化药的PCC(临床前候选化合物),大分子药物最核心的需要确认产品的氨基酸序列、即候选分子。常规流程如下图,每个公司针对各自情况流程或方式可能略有不同。
收集全面信息确认所针对的靶点,并拟定欲开发抗体药物的形式,如单抗、双抗、ADC等。制备相应的抗原,选择合适的动物进行免疫。利用杂交瘤、抗体库、单B细胞克隆等筛选技术对产生抗体进行筛选,得到阳性的克隆,测序后瞬时转染(瞬转)表达mg蛋白进行一系列的成药性分析。若该序列仍存在各方面问题,应对该序列进行进一步优化,使其成药性更优。
这样的过程会是一个反复的过程,直到得到若干候选分子。之后对若干候选分子进行更大量(g级)的瞬转表达或直接用稳转细胞株表达蛋白,在体外动物模型上确认其有效性和安全性,综合各方面指标,确认最终分子序列。如需进一步完成ADC、双抗等类型,则将其候选分子进行进一步设计组合优化,再进行进一步的成药性评估和动物模型评估,以确定最终的最优组合结构。
1、CMC工艺开发,包括稳转细胞株的构建、上下游工艺、制剂工艺、分析方法开发。
2、进而建立细胞库系统、进行上下游工艺放大确认、分析方法验证。
3、进行中试批次放大生产,进而完成一系列稳定性研究、结构表征研究、毒理学研究、药效学研究、药代动力学研究,以及生产过程中细胞库、生产终末细胞、细胞培养收获液鉴定和除病毒能力验证。
4、最终整理各项资料撰写申报材料进行临床试验申请(IND)。

3临床试验和CMC开发
该部分为获得临床默示许可后进行的临床试验和CMC开发工作。
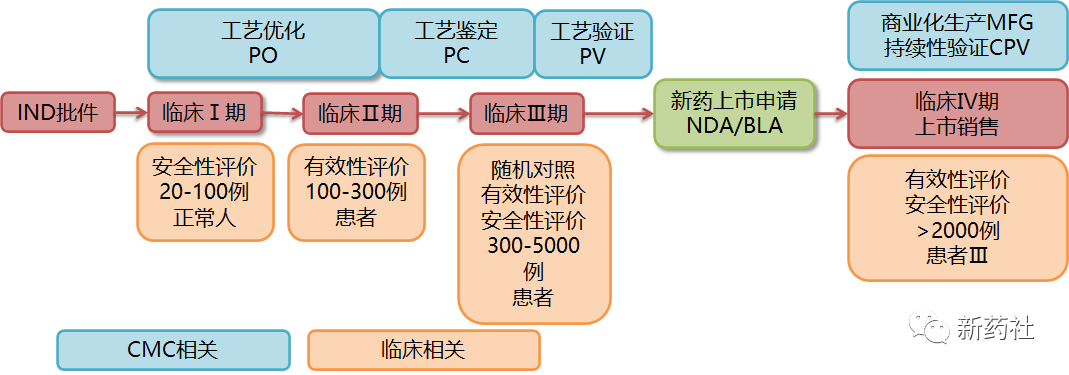
临床试验大致分为四期,Ⅰ期在正常人体上进行(如抗肿瘤药物等特殊药品,会直接在患者上进行),主要进行安全性评估;Ⅱ期在患者上进行,主要进行有效性评估;Ⅲ期会在更多的患者上进行随机对照试验,进一步对有效性和安全性进行评估,达到预期指标后即可进行新药上市申请(NDA/BLA);在上市后进行Ⅳ期,考察在广泛使用条件下的药物的疗效和不良反应、评价在普通或者特殊人群中使用的利益与风险关系以及改进给药剂量等。
在临床试验过程中,CMC开发工作需同步进行,主要包括工艺优化(PO)、工艺鉴定(PC)以及工艺验证(PV),对上下游工艺、制剂工艺、分析方法进行进一步的完善,进一步细化控制策略和质量标准,同时调试生产设备,提高工艺与设备的适配性,已确保商业化生产的产品质量稳定可靠。最终锁定各项工艺、方法、质量标准,达到Ⅲ期临床指标即可新药上市申请(NDA/BLA),获批后即可开展商业化生产(MFG),供应给患者用药。同时上市后仍需对生产各环节进行持续性验证(CPV),也持续保障药品安全、有效、质量可控。